
IgG中的二硫键结构在进化过程中是高度保守的,并曾被认为是一个统一的、同质的结构特征。然而,大量IgG的详细表征揭示了天然人源和重组IgG抗体的几个新结构特征。
IgG抗体的四个亚型:IgG1、IgG2、IgG3、IgG4,其二硫键结构存在许多相似与不同之处(图1)。每个IgG包含12个链内二硫键,每个二硫键都局限于一个单独的IgG结构域。不同亚型铰链区二硫键数量不同:IgG1有2个、IgG2有4个、IgG3有11个和IgG4有2个。IgG1的轻链与重链之间通过轻链的最后一个半胱氨酸残基和重链的第五个半胱氨酸残基之间的二硫键连接。然而,对于IgG2、IgG3和IgG4,轻链与重链之间通过轻链的最后一个半胱氨酸残基和重链的第三个半胱氨酸残基之间的二硫键连接。
链内和链间二硫键的溶剂暴露程度不同。形成链间二硫键的半胱氨酸残基位于铰链区(IgG2、IgG3和IgG4重链的第三个半胱氨酸残基除外,该残基位于VH和CH1结构域间),链间二硫键高度暴露在溶剂中。而链内二硫键位于各结构域内两层反平行的β-折叠结构之间,不暴露于溶剂。溶剂暴露的差异具有重要的意义,因为暴露的半胱氨酸残基被认为比不暴露的半胱氨酸残基更具反应性。
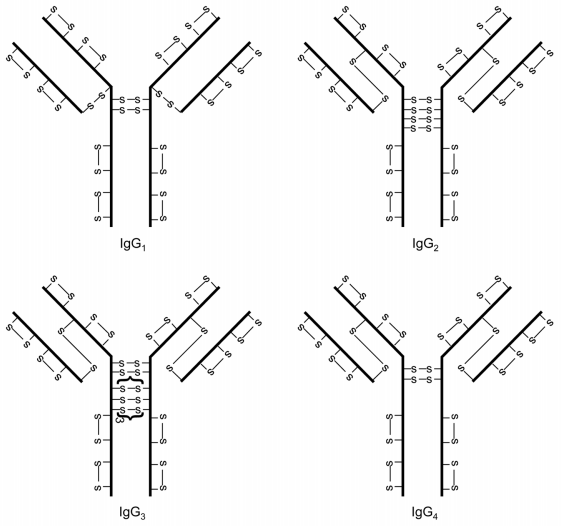
图1 IgG抗体四个亚型的经典二硫键结构
IgG经典二硫键结构以外的结构主要在IgG2和IgG4中被观察到。IgG1的重链间二硫键只有微量以链内形式存在的二硫键变体。IgG3铰链区有重复的氨基酸序列,共有11个二硫键紧挨着,没有多少形成二硫键变体的灵活性。
IgG2的非经典二硫键结构首先在重组单克隆抗体中被观察到,在人源IgG2分子中被证实。我们称经典二硫键结构IgG2A,两个主要的非经典结构IgG2B和IgG2-A/B,后者被认为是介于IgG2A和IgG2B之间的结构中间物(图2)。不同异构体的二硫键分布取决于轻链的类型,IgG22是λ轻链的主要形式;IgG2B是κ轻链的主要形式。在体外血清进行细胞培养的过程中,观察到IgG2A形式向IgG2B的转化。除了来自分子内二硫键连接的异构体外,二硫键连接的二聚体也在由细胞培养获得的重组IgG2和人血清中的IgG2中发现。
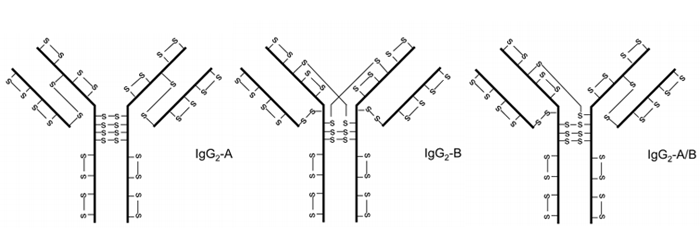
图2 IgG2三种二硫键结构
IgG中最被人熟知的非经典二硫键结构来自IgG4(图3)。非还原SDS-PAGE分析时,可以观察到大量的IgG4为半分子,但SEC分析中却没有观察到,这表明两个半分子是通过非共价相互作用。IgG1和IgG4铰链区有一个氨基酸有所差异:IgG1中有两个脯氨酸残基,IgG4中有一个丝氨酸和一个脯氨酸残基。用脯氨酸残基取代IgG4丝氨酸残基,重链间二硫键稳定性有所提升。由于IgG4重链间二硫键的不稳定性,可以在体外还原条件下获得双特异性抗体,也可以通过将等量的两个针对不同抗原重组IgG4抗体注射到免疫缺陷的小鼠体内获得。
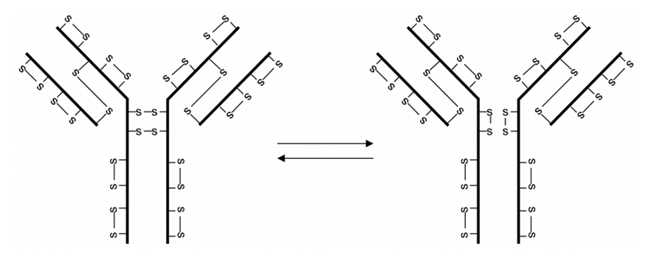
图3 IgG4两种二硫键结构
通常认为IgG中的所有半胱氨酸残基都处于二硫键的状态。实际上,游离巯基在IgG中常被检测到,包括来自血清中的IgG和重组IgG。表1中的两个发现值得讨论:首先,在变性条件下检测到的游离巯基水平更高。这表明,游离巯基与参与链间和链内二硫键的半胱氨酸残基有关。第二,在变性条件下,不同的研究中游离巯基的水平有很大的差异。这种巨大的差异可能是由多种因素造成的,包括不同的IgG类型(人源或重组)、不同的IgG亚型和实验条件变化。
表1 IgG中的游离巯基
| IgG类型 | 游离巯基/IgG | |
|---|---|---|
| 非变性状态 | 变性状态 | |
| 人源IgG2 | 0.24 | ND* |
| 人源IgG1 | 0.1-1.1 | 0.6-4.0 |
| 人源IgG1,IgG4,重组IgG4 | ND* | 0.9-2.2 |
| 重组IgG1,IgG2,IgG4 | 0.02-0.08 | 0.08-0.09 |
| 重组IgG1 | ND* | 0.64 |
| 重组IgG2 | 0.06 | 0.59 |
| 重组IgG2 | 0.158 | 0.379 |
ND*, not determined.
虽然IgG可能有不同程度的游离巯基,但研究表明,结构域中的游离巯基具有类似的分布,至少对于重组IgG1来说,分布类似。轻链可变区的游离巯基含量比恒定区的高。重链CH3结构域的游离巯基水平最高,其次是CH1、CH2和重链可变区。游离巯基的最低水平与链间二硫键有关,这表明游离巯基的低水平很可能是由于二硫键的不完全形成造成的。由于链间二硫键溶剂接触水平更高,故其比链内二硫键更容易降解,如果二硫键降解产生了游离巯基,预计与链间二硫键相关的游离巯基水平会更高。
上述以外的分布可能表明在特殊情况下,特定区域的二硫键不能有效地形成。到目前为止,文献中已经报道了两种特殊情况。在这两种情况下,重链可变区中的链内二硫键没有完全形成,以至于通过疏水作用或弱阳离子交换色谱法检测到了具有这种不完全二硫键的抗体。这种特殊的二硫键的完全形成可以通过在细胞培养中加入硫酸铜来实现,这说明细胞培养条件可以影响二硫键的形成。在血清中体外培养后的抗体或给药后从大鼠血清中重新获得的抗体显示不完全二硫键的形成显著减少。
在碱性条件下,二硫键可以通过β-消除机制分解,形成脱氢丙氨酸和过硫化物,后者可以恢复为半胱氨酸残基。IgG的轻链和重链之间的二硫键通过β-消除机制降解,随后产生的半胱氨酸和脱氢丙氨酸交联,导致了不可还原的硫醚键的形成。有研究发现硫醚键在4℃储存的重组单克隆IgG1中存在的量约占0.4%,在热应激的样品中则高达13.6%。脱氢丙氨酸的水解是除了肽键水解之外导致抗体铰链区分裂的另一个重要机制。
三硫键的形成是蛋白质的一种罕见的翻译后修饰,最早在重组单克隆IgG2中发现,四个重链间二硫键中的一个或两个可能以三硫键的形式存在。后来在重组IgG抗体的所有亚型中都检测到了三硫键,从来自骨髓瘤患者的人源IgG中也检测到了三硫键。通常重链和轻链间二硫键的半胱氨酸残基可以观察到更高水平的三硫键。重组单抗中的三硫键被认为是在发酵过程中,完整的二硫键与溶解的硫化氢(H2S)发生反应形成的。这一结论通过培养IgG与H2S产生了更高水平的三硫键得到了支持。在pH值为7.5的情况下,当重组的IgG2抗体与各种不同类型的抗体培养时,观察到三硫键向二硫键的大量转化。而在另一项研究中,人们发现三硫键在pH6.5的缓冲液和体外大鼠血清中是稳定的。然而,在腹腔注射大鼠血清24h后重新获得的重组IgG1中三硫键完全转化为二硫键。
非经典结构、游离巯基、三硫键等对抗体结构、稳定性和功能影响的信息有限,根据有限信息可以发现:
(1)IgG2B结构比IgG2A的更紧凑;IgG2A与IgG2B结合亲和力和生物活性相似,或IgG2A比IgG2B更高。
(2)对于IgG4的稳定性,用丝氨酸取代IgG4铰链区第一个的半胱氨酸,或用脯氨酸取代IgG4铰链区的丝氨酸,产生的突变抗体不影响抗原结合活性,且更稳定,并有可能增加半衰期。
(3)游离巯基对IgG的结构、稳定性和生物功能的影响:
a)没有完整链内二硫键的CL结构域、CH3结构域和单链可变区的个别结构域显示出较低的稳定性,但没有实质性的结构上的变化。
b)游离巯基的数量越多,重组抗体和人源IgG抗体的热稳定性就会越差。
c)与IgG1相比,IgG2具有更高的聚集倾向,这也是由于IgG2的游离巯基水平较高。
d)完整的二硫键并不是抗原结合的先决条件。但有研究指出,重组单克隆抗体的重链可变区中的二硫键形成不完全,导致效力显著下降。
异质性是重组单克隆抗体的共同特征,与二硫键结构相关的翻译后修饰和变体是异质性产生的潜在原因。研究表明,在抗体组装完成后,链内二硫键一般来说较为稳定。与这些链内二硫键相关的低水平的游离巯基可能是由于二硫键的形成不完全。另一方面,链间二硫键暴露且不稳定,这也会提高重组抗体的异质性。从理论上讲,非原生二硫键结构有可能引发免疫反应。因此,在重组单抗表达的过程中,应密切关注这些二硫键相关结构,并在未来研究中持续关注二硫键相关结构变体对重组抗体的稳定性、结构和生物功能的影响。
参考文献
Liu H, May K. Disulfide bond structures of IgG molecules: structural variations, chemical modifications and possible impacts to stability and biological function. MAbs. 2012;4(1):17-23.

18新利luck·(中国) Nanjing Detai Bioengineering Co.,Ltd. ©2024 All Rights Reserved
苏ICP备2021019379号-1 | 网站地图 | 用户协议 | 隐私政策